Research Institute for Protein Science Co.Ltd.
株式会社 蛋白科学研究所

〒467-0002 愛知県名古屋市瑞穂区川澄町2丁目13番地コーポ川澄204号
(株)蛋白科学研究所
Tel: 052-841-8921
Research Institute for Protein Science Co.Ltd.
株式会社 蛋白科学研究所

〒467-0002 愛知県名古屋市瑞穂区川澄町2丁目13番地コーポ川澄204号
(株)蛋白科学研究所
Tel: 052-841-8921
平成29年3月現在
● 商号:株式会社蛋白科学研究所(Research Institute for Protein Science Co.Ltd.)
● 所在地:〒467-0002 愛知県名古屋市瑞穂区川澄町2丁目13番地コーポ川澄204号
● 設立年月日:平成13年(2001年)12月21日
● 資本金:94,750,000円
● 決算期:12月(年1回)
● 取引銀行:愛知銀行 桜山支店
● 会社の沿革
平成13年12月資本金1,000万円で設立
→名古屋市立大学大学院医学研究科岡田秀親教授の技術シーズをもとに,バイオベンチャーとして設立
平成15年05月資本金 2,000万円に増資
平成16年04月資本金 3,000万円に増資
平成17年04月資本金 4,000万円に増資
平成17年12月資本金 5,900万円に増資
平成19年02月資本金 6,650万円に増資
平成21年03月資本金 7,150万円に増資
平成23年10月資本金 8,475万円に増資
平成27年12月資本金 9,475万円に増資
1. 活性阻害ペプチドの設計開発及び受託設計
2. 上記に関連する事項についての研究開発及び受託研究
3. 癌免疫療法に関する治療相談
抑制したいとお考えの蛋白質の機能を制御するペプチド候補を設計します
お問い合わせ先
〒467-0002 愛知県名古屋市瑞穂区川澄町2丁目13番地コーポ川澄204号
Tel: 052-841-8921
Web: http://www.prsc.jp/
設計責任者
所長 岡田秀親 (名古屋市立大学名誉教授:医学博士)
(1)蛋白質の標的部位としては以下のような部位が良いと考えられます。
a. リガンド、レセプター、基質等との結合部位を構成している。
b. アミノ酸置換実験等で活性の維持に重要な部位であることが示されている。
c. 糖鎖修飾などを受けている部位を含まない。
(2)標的部位のペプチドは15~20アミノ酸の長さが適当と考えられます。
(3)相補性ペプチド候補の設計にはMIMETIC (Microbiol. Immunol. 46: 211, 2002) を用います。
(4)蛋白質内の一つの標的ペプチドに対して、相補性ペプチド候補のアミノ酸配列 を10種類提供します。
【注】 設計合成した相補性ペプチドの例
1)HIV感染制御作用を有するアンチセンスペプチド(特許2000-277747)
2)トロンボモジェリン機能阻害ペプチド(特願2003-102267)
3)アナフィラトキシンC5a を不活性化するペプチド(特許第4106691号)
4)プロカルボキシペプチダーゼR 活性化を阻害ペプチド(特許第4085190号)
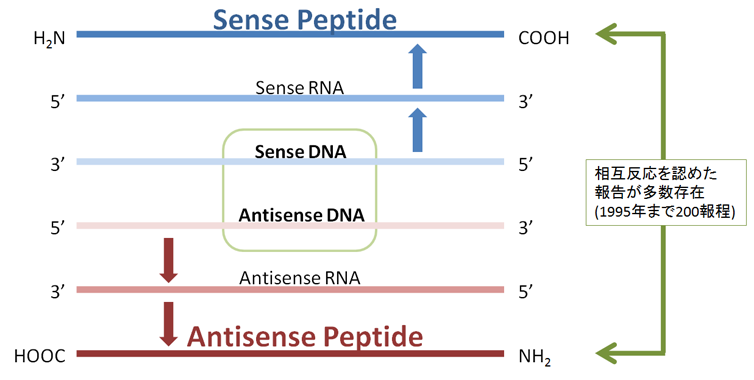
蛋白質は長く連なったポリペプチド鎖から成るが、分子内では、アミノ酸配列自身が情 報化され、分子内にセンスペプチド・アンチセンスペプチドの関係によって、相互に対 応する配列情報を持つ部分が散在することを発見しました(Nature Med. 1: 894, 1995)。 従って、蛋白質の構造や活性に関わる部分に対応する相補性ペプチドを設計合成して作 用させれば、機能を抑制できると考え、対応する相補性ペプチドを設計合成するコンピ ュータプログラムMIMETIC を作成しました(Microbiol. Immunol. 46: 211, 2002)。設計 合成したペプチドの約30%が標的タンパク質の機能を抑制する結果を得ています。
大型コンピューター等を用い、蛋白質の高次構造をシュミレーションして活性部位に特異的 に反応できる薬剤を開発する分子標的創薬が盛んに行われ、ある程度の成果も挙がっているが、
コストパフォーマンスは高いとは言えないのが現状です。
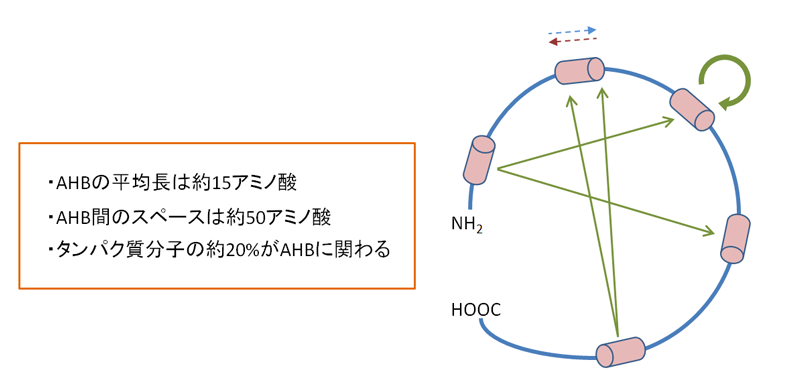
我々は、蛋白質の高次構造の形成と維持に、蛋白質分子内のAntisense Homology Box (AHB)と命名した部分のアミノ酸配列が相互にアンチセンスアミノ酸となっている部位 間で相互反応をおこし、高次構造の形成と維持に重要な働きをしていることを提唱しまし た(Nature Med. 1: 894, 1995)。このAHB の概念を基盤において蛋白質の活性を阻害す るペプチドを効率よく設計するコンピュータプログラムであるMIMETIC を作製しまし た(Microbiol. Immunol. 46: 211, 2002:特願2002-93294)。
そのMIMETICで作成した相補性ペプチドの約30%が特異的な阻害活性持っていま した。アシル化やメチル化などの化学修飾などを行って安定性を高めるなどにより、実 用化に耐えるペプチドを作成できると考えられます。

アミノ酸をコードする3塩基からなるコドンのアンチコドンの塩基配列でコードさ れるアミノ酸。左右、どちらから読まれた場合のアミノ酸を全て含めています。

標的ペプチド(センスペプチド)に対して各部位のアミノ酸がアンチセンスアミノ酸 で構成されているペプチドをAntisense peptide と呼ぶ。我々は通常、80%以上のア ミノ酸がアンチセンスアミノ酸で構成されているペプチドを含めています。

標的のペプチドに対して、疎水性パターンが逆の値になって相補性になっていること、 対応する位置のアミノ酸側鎖の容積(bulkiness)が対応性でアミノ酸同士のα 炭素が5 オングストローム以内に接近できること、ペプチド骨格のバックボーン並列性 (Backbone alignment)の一致性などを指標に設計したペプチドです。その自動設計をす るコンピュータープログラムがMIMETIC(Microbiol Immunol. 46:211, 2002:特願 2002-93294)です。設計した相補性ペプチドの内、約30%が標的蛋白質に対して阻 害活性を示しています。HIV 逆転写酵素阻害ペプチド、トロンボモジュリン阻害ペプ チド、TAFI 活性化阻害ペプチド、C5a 阻害ペプチドなどが創生できています。C5a 阻 害ペプチドは敗血症治療用特効剤として開発が進み前臨床試験段階です。

相補性ペプチドを自動設計するプログラムソフトに付けた名称です。

蛋白質分子内のアミノ酸配列が相互にアンチセンスペプチドとなっている部位が平 均すると約50アミノ酸の間隔をおいて散在していることを発見し、その様な部位を Antisense Homology Box(AHB)と命名した。AHB 間で相互反応をおこし、高次構 造の形成と維持に重要な働きをしていることを提唱した(Nature Med.1:894,1995)。